 更新時間:2025-09-19
更新時間:2025-09-19 點擊次數(shù):173
點擊次數(shù):173
癌癥疫苗通過激活細胞毒性T淋巴細胞(CTLs)來攻擊腫瘤細胞,但其效果常因免疫原性不足、抗原呈遞效率低以及腫瘤微環(huán)境(TME)的免疫抑制特性而受限。為克服這些挑戰(zhàn),作者開發(fā)了一種病毒模擬納米疫苗(cGAMP@vEVs),通過工程化腫瘤細胞來源的細胞外囊泡(tEVs),使其表達病毒相關蛋白(VSVG和CRT),并加載STING通路激活劑cGAMP,以增強抗腫瘤免疫反應。
cGAMP@vEVs通過VSV感染腫瘤細胞制備,加載cGAMP后展現(xiàn)出良好的穩(wěn)定性。體外實驗表明,cGAMP@vEVs能夠被同源腫瘤細胞和樹突狀細胞(DCs)高效攝取,顯著激活STING通路,促進IFN-β產生,增強DCs成熟和T細胞激活。體內實驗表明cGAMP@vEVs在腫瘤和淋巴結中高效積累,顯著增加腫瘤內CD4+和CD8+ T細胞比例,降低調節(jié)性T細胞(Tregs)比例,增強腫瘤特異性CD8+ T細胞浸潤。此外,cGAMP@vEVs顯著抑制腫瘤生長、轉移和復發(fā),延長小鼠生存期,且未引起明顯的肝腎功能損傷或病理組織變化。
綜上,cGAMP@vEVs作為一種新型納米疫苗,通過工程化細胞外囊泡實現(xiàn)了高效抗原遞送和免疫激活,為癌癥免疫治療提供了新思路。
基本信息

題目:Engineered virus-mimicking nanovaccine with lymph node–tumor dual-targeting and STING-activating capacity for robust cancer immunotherapy
期刊:Journal of Controlled Release
影響因子:10.5
PMID:39694072
通訊作者:黃利利a 梅林c 呂桂紅b 張帆c
作者單位:a北京理工大學醫(yī)學技術學院;b深圳市兒童醫(yī)院兒童保育與心理健康中心;c中國醫(yī)學科學院&北京協(xié)和醫(yī)學院生物醫(yī)學工程研究所
索萊寶合作產品:
貨號 | 名稱 |
K109190P | ActivAbTMAnti-CD47 Polyclonal Antibody |
K001677P | ActivAbTMAnti-CD44 Polyclonal Antibody |
K002267P | ActivAbTMAnti-CDH1 Polyclonal Antibody |
PC0020 | BCA蛋白濃度測定試劑盒 |
摘要

癌癥疫苗在腫瘤免疫治療領域備受關注,但其療效受限于細胞毒性T淋巴細胞(CTL)的增殖不足、活化不足及腫瘤浸潤困難。受病毒成分的強免疫刺激特性及病毒感染誘導的免疫原性細胞死亡(ICD)中鈣網蛋白暴露的啟發(fā),該研究開發(fā)了一種仿病毒納米疫苗策略cGAMP@vEVs:通過病毒感染工程化腫瘤細胞來源的胞外囊泡,使其共同負載個性化/廣譜抗原庫及多種免疫佐劑,以高效激發(fā)抗腫瘤免疫。實驗表明cGAMP@vEVs兼具優(yōu)異的淋巴結-腫瘤雙靶向能力和STING通路激活能力,可驅動淋巴結內腫瘤特異性CD8+ T細胞的增殖與活化;同時主動富集于腫瘤部位,改善免疫抑制性腫瘤微環(huán)境(TME),促進CTL的自發(fā)浸潤。這種免疫響應與TME重塑的協(xié)同作用重啟了癌癥免疫的自循環(huán),從而有效抑制腫瘤進展、轉移與復發(fā)。
研究內容及結果
01
cGAMP@vEVs的制備及表征
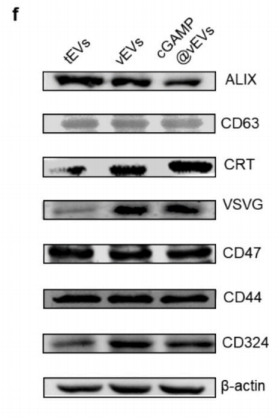
Western blot驗證了vEVs中存在VSVG和CRT,而tEVs中不存在,盡管兩者都表現(xiàn)出高水平的代表性CD63和ALIX蛋白,以及與腫瘤自身識別相關的CD324和CD47蛋白,還有4T1細胞的自身標記物CD44。vEVs的產量大約是tEVs的1.6倍,表明VSV感染促進了細胞外囊泡從其親本細胞的產生。通過電穿孔將STING激動劑cGAMP加載到vEVs中,當vEVs與cGAMP的質量比為1:4時,加載達到飽和,最大加載效率約為14%。cGAMP@vEVs的尺寸在cGAMP加載后從100.04±1.70穩(wěn)定增加到138.69±4.84。如圖1g所示,cGAMP和VSVG在cGAMP@vEVs中很好地共定位(共定位效率:91.4%)。

圖1
02
cGAMP@vEVs被腫瘤細胞
和樹突狀細胞的靶向攝取
如圖2a所示,與其他細胞系相比,同型4T1細胞在2小時孵育后顯示出更多的cGAMP@vEVs(用4T1細胞的vEVs加載cGAMP)。定量分析表明cGAMP@vEVs處理的4T1細胞的平均熒光強度(MFI)大約是cGAMP@vEVs處理的HepG2(人肝細胞癌)、B16(小鼠黑色素瘤)、CT26(小鼠結腸癌)或HC11(小鼠正常乳腺)細胞的3-10倍。如圖2c所示,與cGAMP@tEVs相比BMDCs顯示出更多的cGAMP@vEVs。cGAMP@vEVs陽性BMDCs的百分比大約是cGAMP@tEVs陽性BMDCs的1.38倍,表明vEVs上的CRT顯著增強了BMDCs對cGAMP的攝取效率。

圖2
03
STING通路激活與
腫瘤相關抗原交叉呈遞
共聚焦成像和共定位效率分析表明大多數(shù)tEV遞送的Cy5-cGAMP在與BMDCs共孵育6小時后與內質網和溶酶體共定位,而大多數(shù)vEV遞送的Cy5-cGAMP分散在細胞質中。與單獨用cGAMP或cGAMP@tEVs處理的BMDCs相比,用cGAMP@vEVs處理的BMDCs顯示出顯著增強的磷酸化IRF3和TBK1的表達。與cGAMP或cGAMP@tEV處理的BMDCs相比cGAMP@vEVs處理的BMDCs產生了高水平的IFN-β(51.51±3.12 pg/mL),而cGAMP或cGAMP@tEV處理的BMDCs僅誘導了低或中等水平的IFN-β(分別為24.14±1.05和35.70±1.60 pg/mL)。此外,cGAMP@vEV處理導致同源腫瘤細胞中磷酸化IRF3和TBK1的表達增強。
如圖3k-n所示,與cGAMP處理的BMDCs相比,cGAMP@vEVs處理的BMDCs中MHC-I和CD80CD86的表達水平顯著上調,分別為1.94倍和1.62倍;與cGAMP@tEVs處理的BMDCs相比,分別為1.23倍和1.29倍,表明DC成熟。此外,cGAMP@vEVs誘導BMDCs產生高水平的腫瘤壞死因子-α(TNF-α)和白細胞介素-6(IL-6)。在cGAMP@vEVs處理后觀察到CD3+ CD8+ T細胞群中CD69+ T細胞的百分比增加,伴隨著IFN-γ和顆粒酶B的產生增加,表明T細胞激活效率高。
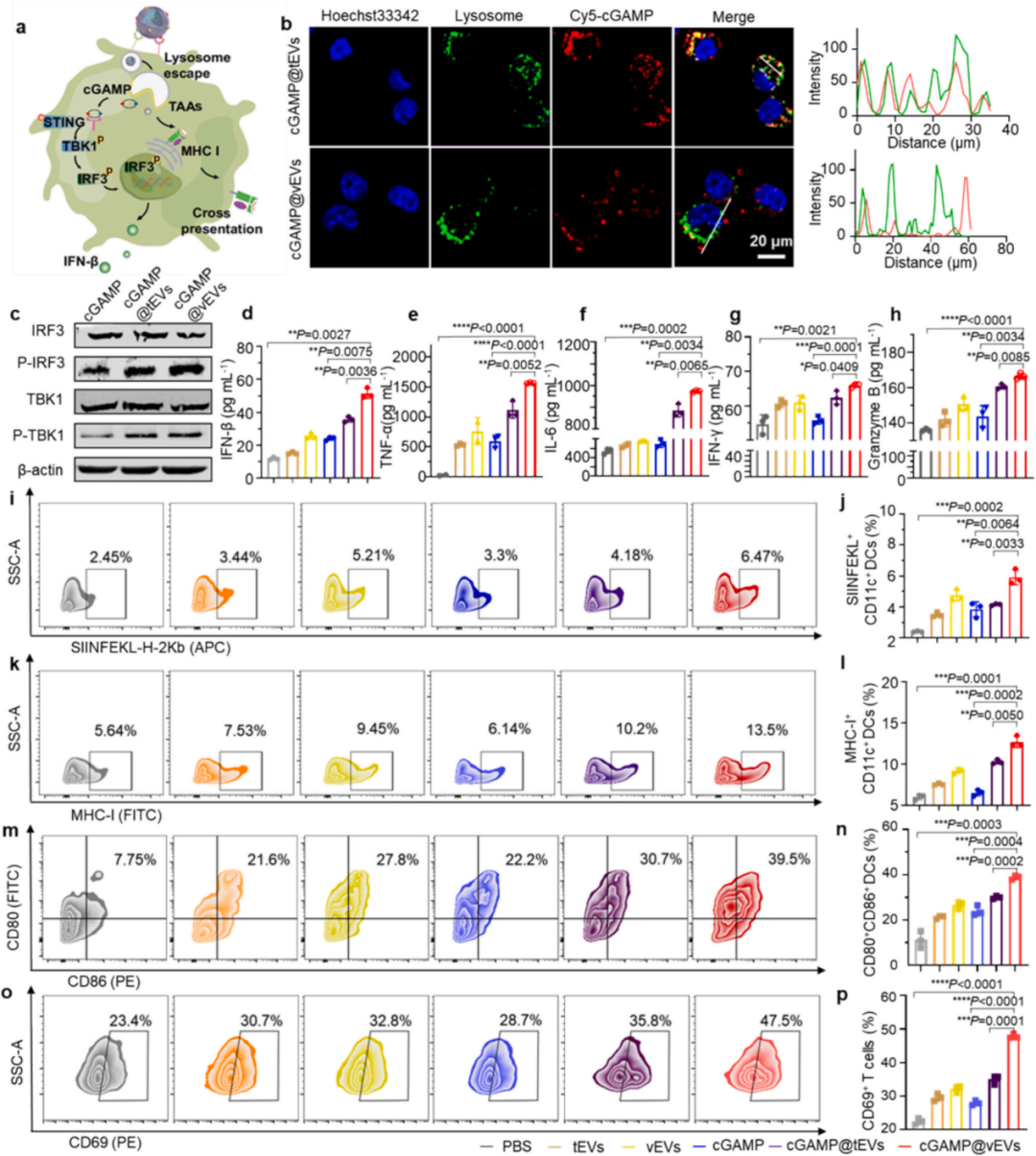
圖3
04
體內腫瘤-淋巴結雙靶向與免疫激活
DiR信號逐漸在腫瘤和LNs中積累,并在注射后48小時達到峰值;然而在正常組織中幾乎檢測不到。DiR標記的cGAMP@vEVs的峰值強度在腫瘤中與DiR標記的tEVs相當,而在LNs中大約是后者的兩倍。大量cGAMP@vEVs在LNs中積累并與DCs共定位,證實cGAMP@vEVs能夠有效地遷移到LNs并與DCs在體內特異性相互作用。
此外,與cGAMP@tEVs處理的小鼠相比cGAMP@vEVs處理的小鼠的LNs中包含更多的免疫細胞,這些共定位的DCs與CD4+和CD8+ T細胞高度共定位(共定位效率分別為99.6%和98.9%),表明潛在的T細胞激活。cGAMP@vEVs處理的小鼠的腹股溝LNs中DCs的CD80 CD86和MHC-II的表達水平最高,從12.1%和12.3%分別增加到40%和37.2%。與單獨用cGAMP或cGAMP@tEVs處理的小鼠相比,cGAMP@vEVs處理的小鼠中DCs的MHC-I表達水平分別增加了1.59倍和1.14倍。此外,cGAMP@vEVs處理導致引流LNs中CD11c+SIINFEKL-H-2Kb+抗原交叉呈遞DCs的最大水平。

圖4
05
腫瘤微環(huán)境調控與腫瘤進展抑制
與調節(jié)性T細胞(Tregs,CD25+Foxp3+)相比,CD4+(CD4+CD3+)和CD8+(CD8+CD3+)T細胞的百分比顯著增加。cGAMP@vEVs注射導致腫瘤內CD8+和CD4+ T細胞與Tregs的比例分別增加了8.69倍和14.4倍。此外,cGAMP@vEV處理顯著增加了腫瘤內CTLs(CD3+CD8+IFNγ+)的豐度。如圖5h所示,與PBS組相比,用vEVs處理的腫瘤顯示出許多免疫激活相關基因的上調表達,如CXCL10、CD40和TLR9,以及免疫抑制基因的下調表達,如MMP10和VEGFA。癌癥促進因子如TGFB2和ARG1也被下調。
與PBS組相比,vEV處理組的細胞因子-細胞因子受體相互作用、Toll樣受體信號通路和趨化因子信號通路顯著激活。與單獨用cGAMP、cGAMP + vEVs或cGAMP@tEVs處理的組相比,cGAMP@vEVs組顯示出更明顯的腫瘤生長抑制。此外,其他組的小鼠在45天內死亡;然而,>83%的cGAMP@vEVs組小鼠存活。

圖5
06
抑制腫瘤轉移和復發(fā)
如圖6b所示,在用PBS、tEVs、vEVs、cGAMP或cGAMP@tEVs處理的小鼠中觀察到明顯的肺轉移,而在用cGAMP@vEV處理的組中幾乎未觀察到轉移。此外,cGAMP@vEV處理組的肺轉移瘤數(shù)量和肺重量顯著減少(圖6c-d),突顯了cGAMP@vEVs在抑制腫瘤轉移方面的顯著優(yōu)勢。
cGAMP@vEVs處理組顯示出顯著的腫瘤生長抑制和更長的存活時間,腫瘤抑制率為50.6%(圖6f-h)。定量分析顯示,cGAMP@vEVs處理組小鼠脾臟中腫瘤特異性CD8+ T細胞的百分比顯著增加(圖6i)。此外,與PBS對照組相比,cGAMP@vEVs處理組小鼠脾臟中的效應記憶T細胞(TEM)(CD3+CD8+CD62L-CD44+細胞)增加了27.9%(圖6j-k)。

圖6
結論
該研究創(chuàng)新性地利用水皰性口炎病毒(VSV)感染的工程化腫瘤細胞來源的胞外囊泡(vEVs),構建了一種仿病毒納米疫苗cGAMP@vEVs。該疫苗通過VSV-G糖蛋白和鈣網蛋白(CRT)的協(xié)同作用,實現(xiàn)了淋巴結與腫瘤組織的雙重靶向:一方面激活淋巴結中的STING通路以促進T細胞活化與增殖,另一方面直接作用于腫瘤微環(huán)境以逆轉免疫抑制狀態(tài)。與傳統(tǒng)疫苗相比,該策略突破性地實現(xiàn)了多腫瘤抗原與佐劑cGAMP的共遞送,克服了單一抗原免疫原性不足的缺陷,在顯著提升疫苗生物利用度的同時確保了良好的安全性特征。
從臨床轉化角度來看,該技術方案具有顯著的實用優(yōu)勢。可快速制備個性化疫苗,其工藝流程相較于新抗原疫苗或過繼性細胞治療更為簡便可靠,為腫瘤免疫治療的臨床推廣提供了新的技術路徑。然而,要實現(xiàn)該療法的臨床應用,仍需通過大型動物實驗驗證其規(guī)模化制備的穩(wěn)定性,在患者來源異種移植(PDX)模型中系統(tǒng)評估其治療效能,并建立規(guī)范的長期安全性評價體系。
索萊寶產品亮點


相關產品
SOLARBIO

貨號 | 名稱 |
K003025P | ActivAbTMAnti-CD47 Polyclonal Antibody |
K010112M | ActivAbTMAnti-CD47 Monoclonal antibody |
K115123P | ActivAbTMAnti-CD44 Polyclonal Antibody |
K002758P | ActivAbTMAnti-CD44 Polyclonal Antibody |
K007092P | ActivAbTMAnti-CD44 Polyclonal Antibody |
K106561P | ActivAbTMAnti-CADH1 Polyclonal Antibody |
K111304P | ActivAbTMAnti-CDH1/2/3/4 Polyclonal Antibody |
K115158P | ActivAbTMAnti-CDH1 Polyclonal Antibody |
SE131 | ActivAbTM羊抗小鼠IgG-HRP |
SE134 | ActivAbTM羊抗兔IgG-HRP |
K1031G-AF594 | ActivAbTMSolar Fluor 594標記的羊抗小鼠IgG |
SF134 | ActivAbTM羊抗兔IgG-FITC |
Copyright © 2025 北京索萊寶科技有限公司版權所有 備案號:
技術支持:化工儀器網 管理登錄 sitemap.xml